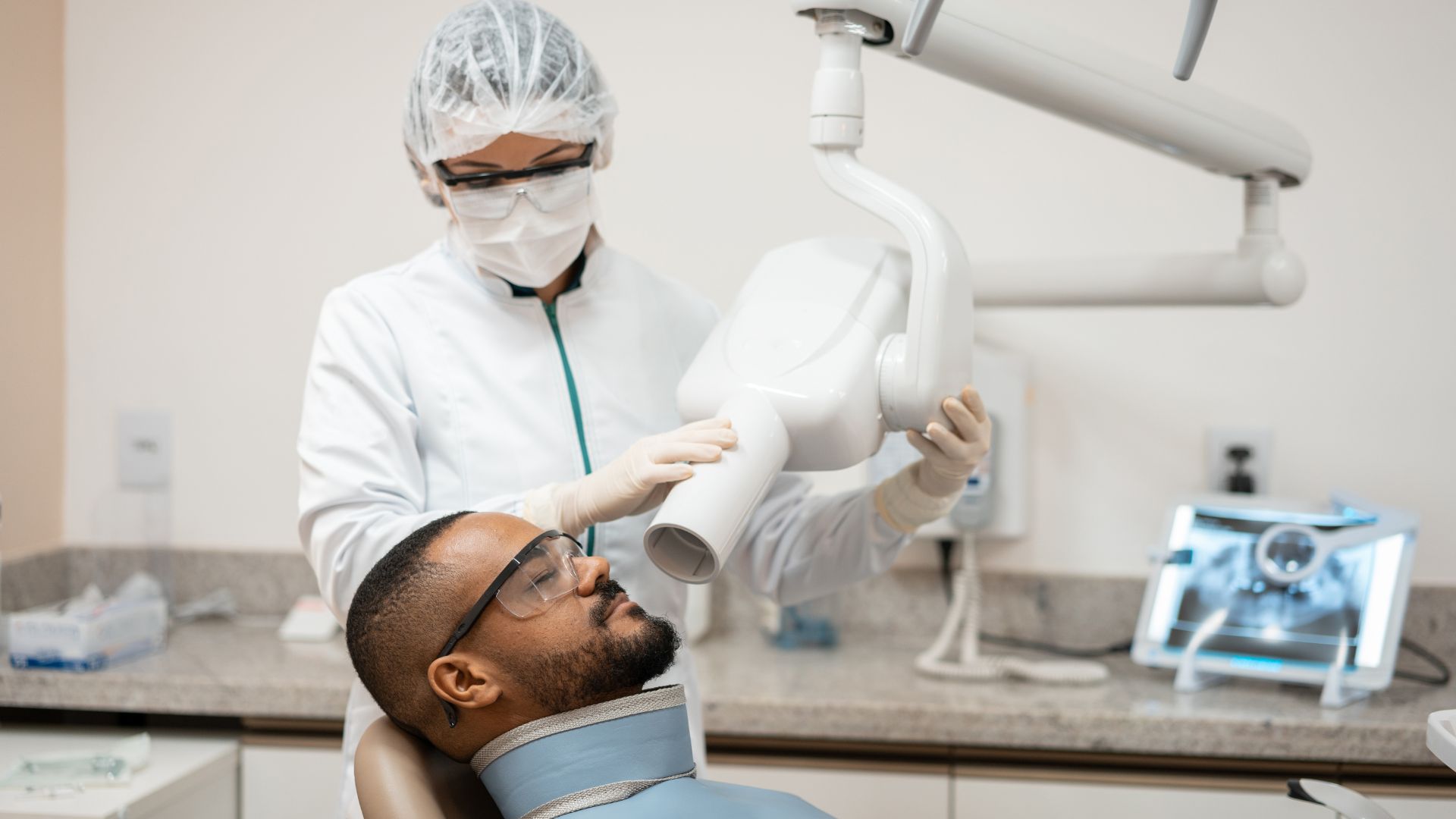
Las máquinas de rayos X dentales y los equipos de obtención de imágenes son herramientas esenciales en la odontología moderna, lo que ayuda en el diagnóstico y la planificación del tratamiento. Dado que estos dispositivos emiten radiación, la FDA aplica estrictos controles normativos para garantizar la seguridad y la eficacia. Los fabricantes de escáneres de TC intraorales, extraorales, panorámicos y de haz cónico (CBCT) deben cumplir con las normas de dispositivos médicos y dispositivos emisores de radiación (RED) de la FDA. El incumplimiento puede dar lugar a alertas de importación, detenciones y acciones de aplicación que retrasan la entrada en el mercado.
Cómo clasifica la FDA los dispositivos de rayos X dentales
La clasificación de la FDA se basa en el riesgo y la función del dispositivo:
- Clase I (bajo riesgo): Incluye accesorios como soportes de película y delantales de plomo. Exento de 510(k), pero aún requiere registro de establecimiento y listado de dispositivos médicos.
- Clase II (riesgo moderado): Cubre la mayoría de los sistemas de rayos X intraorales, extraorales y panorámicos. Estos requieren autorización 510(k).
- Clase III (alto riesgo): Incluye escáneres CBCT, que pueden requerir aprobación previa a la comercialización (Premarket Approval, PMA) debido a una mayor complejidad diagnóstica y exposición a la radiación.
Pasos para comercializar legalmente un dispositivo de rayos X dental en EE. UU.
Los fabricantes deben completar los siguientes pasos para cumplir con las regulaciones de la FDA:
- Registro del establecimiento: Registro anual para todos los fabricantes e importadores.
- Listado de dispositivos médicos: Cada dispositivo debe estar incluido en la lista de la FDA.
- Cumplimiento del dispositivo emisor de radiación (RED): Los dispositivos deben cumplir con los estándares de seguridad radiológica de la FDA.
- Cumplimiento de UDI: Los dispositivos de obtención de imágenes deben contar con un identificador de dispositivo único para su trazabilidad.
- Cumplimiento de etiquetado y publicidad: Las reclamaciones deben ser precisas y no engañosas para evitar acciones de ejecución.
Desafíos y soluciones comunes de cumplimiento
Comprender los obstáculos del mundo real ayuda a los fabricantes a planificar con antelación:
Estudio de caso: Sistema de rayos X detenido debido a falta de cumplimiento de RED
Un fabricante europeo que importaba un sistema de rayos X panorámico a EE. UU. fue detenido por falta de documentación RED. Esto causó:
- Retrasos en el envío al recopilar datos de cumplimiento de la radiación.
- Costes de pruebas adicionales.
- Consultar con el servicio de asistencia para corregir el problema.
Estudio de caso: Clasificación incorrecta de un escáner CBCT
Una empresa clasificó erróneamente un dispositivo CBCT como Clase II en lugar de Clase III. Como resultado:
- El lanzamiento del producto se retrasó hasta la revisión del PMA.
- Fueron necesarios ensayos clínicos.
- Se presentó un formulario 513(g) para la aclaración de la clasificación.
Consideraciones reglamentarias para los fabricantes
- Honorarios de usuario de la FDA: Se requiere anualmente; es posible que haya disponible asistencia para cargos para pequeñas empresas.
- Alertas de importación: Los sistemas que no cumplan con los requisitos pueden estar bloqueados.
- Certificado para gobierno extranjero (CFG): Necesario para la exportación.
- Licencias de Health Canada: Es posible que se necesite un MDEL para las ventas canadienses.
Mantenimiento del cumplimiento después de la entrada en el mercado
Las obligaciones de la FDA no se detienen en el momento de la aprobación. Los fabricantes deben:
- Enviar informes eMDR: Para fallos de funcionamiento del dispositivo o problemas de seguridad.
- Usar solicitudes de FOIA: Obtenga información sobre las autorizaciones de la competencia.
- Mantener un archivo maestro de dispositivos médicos: Para simplificar las presentaciones futuras.
- Involucrar a consultores normativos: Para seguir el ritmo de los requisitos cambiantes de RED y FDA.
Imagen del futuro con total conformidad con la FDA
La introducción de sistemas de rayos X dentales en el mercado estadounidense requiere algo más que protección contra la radiación: requiere precisión en el cumplimiento normativo. Los fabricantes que clasifican correctamente sus dispositivos, mantienen los estándares RED y garantizan un etiquetado preciso pueden agilizar la aprobación, evitar costosos contratiempos y garantizar el éxito a largo plazo.